Qu’est-ce que la Tomographie Cryoélectronique?
La tomographie cryoélectronique (également connue sous le nom de cryotomographie électronique) permet d’analyser les interactions protéine-protéine en résolution moléculaire tridimensionnelle dans leur état natif et fonctionnel. L’échantillon est imagé dans une série d’images bidimensionnelles alors qu’il est incliné dans une série contrôlée de positions. Les «tranches» d’image résultantes peuvent ensuite être combinées pour produire une reconstruction 3D de l’échantillon.
Articles connexes
The Cryo-CLEM Journey
New Imaging Tools for Cryo-Light Microscopy
Improve Cryo Electron Tomography Workflow
Quelles sont les étapes d’un workflow CryoET?
La technique implique la préparation d’échantillons, qui sont sur des grilles de microscopie électronique, puis sont plongés congelés rapidement dans de l’azote liquide pour vitrifier l’échantillon et empêcher la formation de cristaux de glace.
Pour effectuer une tomographie cryo haute résolution, l’épaisseur de coupe de l’échantillon ne doit pas dépasser 300 nm. Pour observer les parties «plus épaisses» des échantillons, comme les corps cellulaires, l’échantillon doit être dilué. Outre l’ultramicrotomie cryogénique, le fraisage par faisceau ionique focalisé (FIB) à l’aide d’un microscope électronique à balayage cryogénique dédié ou multimodal est la méthode de choix. Deux fenêtres de faisceau d’ions sont positionnées de manière à créer une fine plaque de glace (lamelle) d’une épaisseur d’environ 200 nm dans la zone d’intérêt afin de la rendre accessible pour la CryoET.
Les échantillons préparés peuvent maintenant être balayés à l’aide du microscope électronique à transmission cryo, puis le processus de reconstruction des données doit avoir lieu pour reconstruire les images 2D en un seul modèle 3D.
Quels sont les défis d’un workflow CryoET typique?
Le plus grand défi associé à un workflow CryoET typique est la difficulté d’identifier la zone d’intérêt précise contenant la cellule ou la protéine à imager. Des échecs répétés dans le ciblage peuvent entraîner de multiples répétitions d’un processus chronophage, ce qui finit par faire perdre un temps d’imagerie coûteux au microscope électronique (EM). Deux autres défis à relever dans le cadre d'un workflow consistent à s’assurer que la qualité de l’échantillon et l’épaisseur de la glace restent constantes tout au long du processus, ainsi qu’à maintenir une vitrification adéquate des échantillons avant leur transfert vers le MET cryogénique.
Comment les défis de la CryoET peuvent-ils être surmontés grâce à la microscopie optique cryo?
La microscopie optique cryo peut contribuer positivement au workflow CryoET de deux manières importantes.
Premièrement, la microscopie optique permet d’évaluer la qualité de l’échantillon. Le microscopie optique cryo offre un aperçu rapide de la qualité de congélation et de l’épaisseur de glace de l’échantillon, ainsi que de la distribution optimale de l’échantillon pour un traitement ultérieur. Les solutions cryogéniques de Leica garantissent la sécurité et la viabilité des échantillons pendant ces étapes.
Deuxièmement, le plus grand potentiel du microscope optique cryo pour une plus grande efficacité du workflow est sa capacité à cibler la structure d’intérêt beaucoup plus précisément avant le début des préparations chronophages et coûteuses de CryoEM . Les solutions de microscopie optique cryo de Leica permettent l’exportation d’images et de coordonnées de la structure cible vers les étapes EM suivantes, réduisant ainsi considérablement le temps d’imagerie EM.

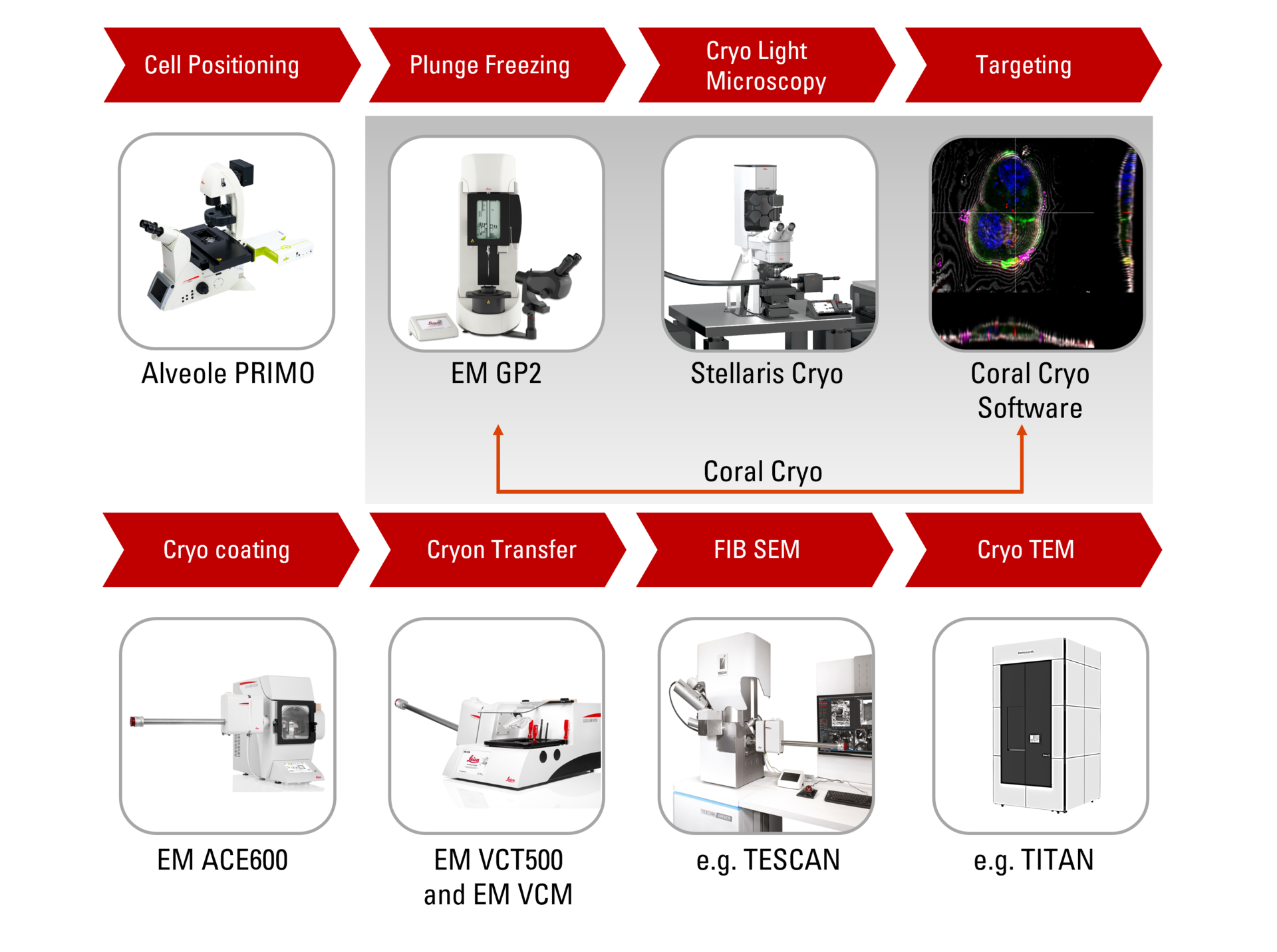
Présentation de Coral Cryo : le workflow CryoET le plus efficace à ce jour
Les solutions de workflow Cryo-ET 3D de Leica permettent de relever les défis habituels en garantissant la viabilité des échantillons, les contrôles de qualité et, surtout, un mécanisme de ciblage 3D précis et fiable. Utilisez notre matériel optimisé, y compris la platine cryo et le shuttle, en conjonction avec le logiciel de ciblage de pointe CryoET, ainsi qu’une variété d’options d’intégration et de transfert transparentes vers des platines cryo FIB ou VCT.
Ciblage précis des volumes en 3D
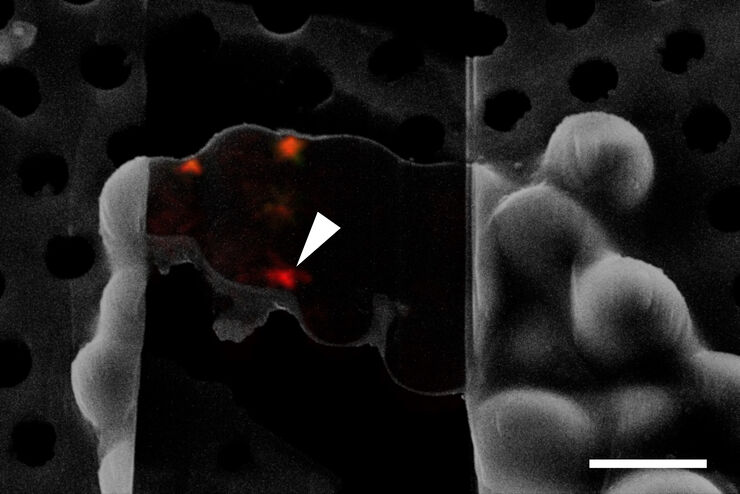
Découvrez comment le workflow continu de tomographie cryo-electron Coral Cryo de Leica Microsystems utilise la super résolution confocale pour cibler votre structure d’intérêt avec une précision accrue. Le workflow réduit et optimise le nombre d’étapes du workflow, améliore le chargement et le transfert des échantillons et augmente ainsi la productivité du workflow CryoET.
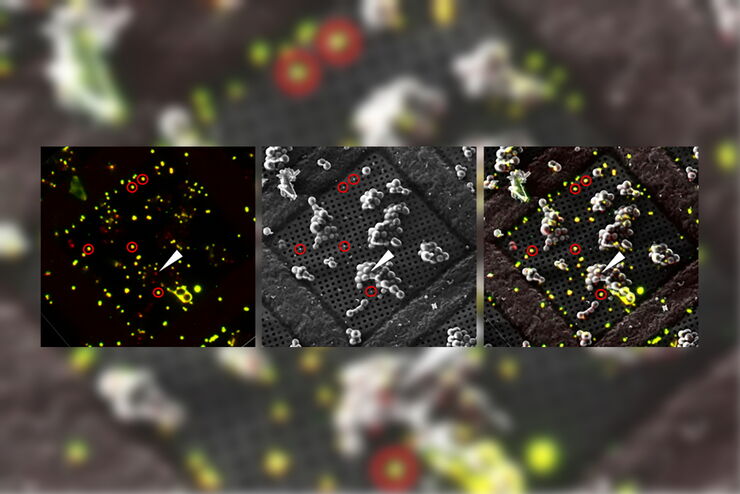
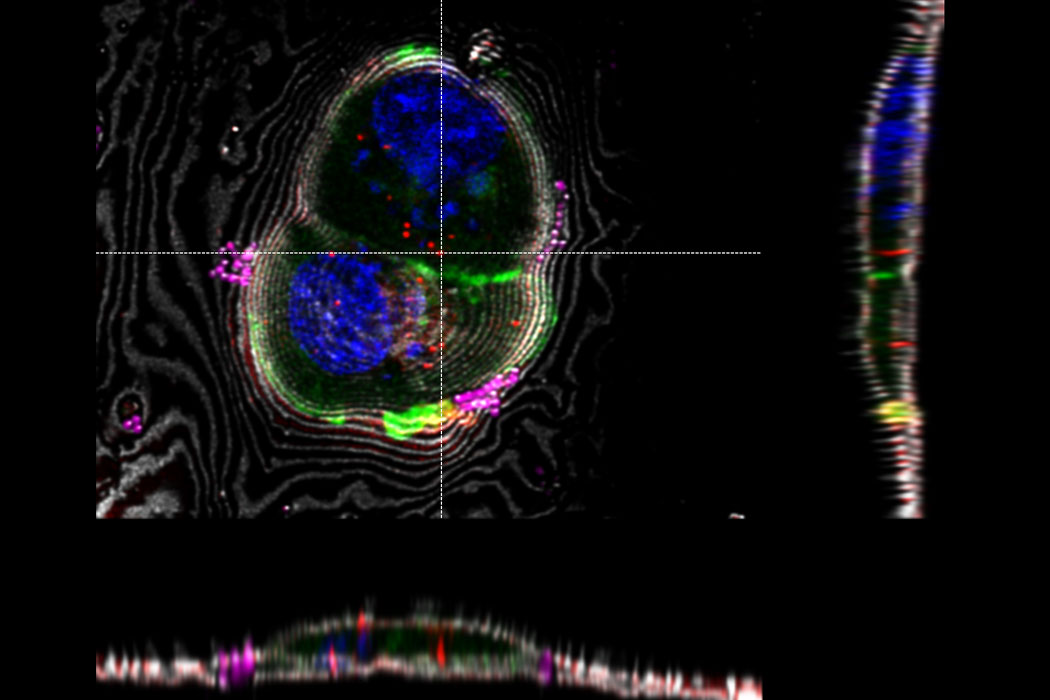
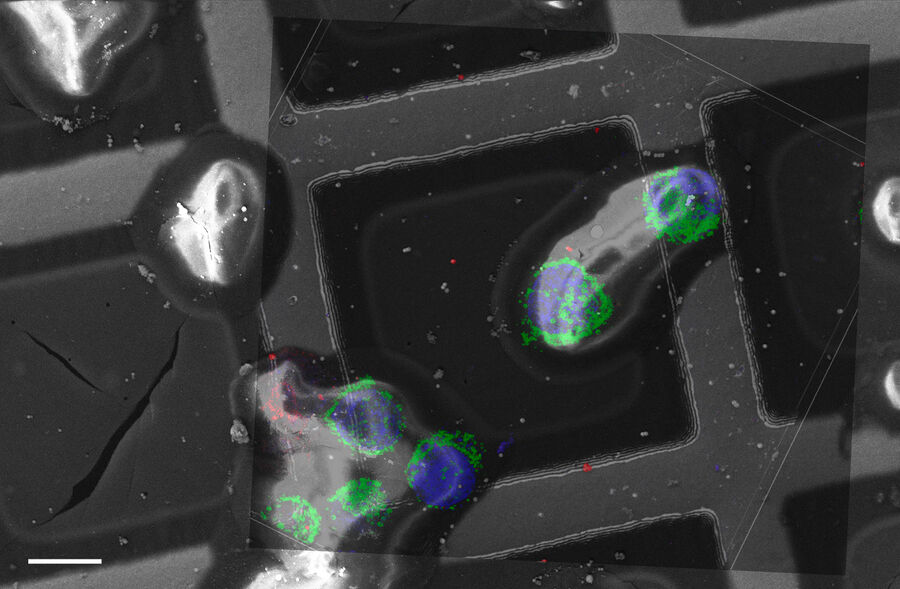
Superposition d’une image confocale 3D superrésolue avec une vue SEM supérieure (panneau de gauche) et une vue FIB (panneau de droite). La superposition a été réalisée en utilisant les billes comme points de repère pour la corrélation. Cellules HeLa marquées comme suit : noyaux par Hoechst, bleu; mitochondries par MitoTracker Green, vert; gouttelettes de lipides par Bodipy et Crimson Beads, rouge). Barre d’échelle: 20 µm. Cellules gracieusement fournies par Ievgeniia Zagoriy et images SEM/FIB aimablement fournies par Herman Fung, Mahamid-Group, EMBL-Heidelberg, Allemagne.
Articles connexes
How to Target Fluorescent Structures in 3D for Cryo-FIB Milling
Targeting Active Recycling Nuclear Pore Complexes using Cryo Confocal Microscopy
Advancing Cell Biology with Cryo-Correlative Microscopy
Workflows and Instrumentation for Cryo-electron Microscopy
Que choisir: Cryo Champ large ou Cryo Confocal?
Caractéristiques | Confocal | Thunder (champ large) |
|---|---|---|
| Sensibilité | * | |
| Vitesse | * | |
| Résolution latérale | ** | * |
| Résolution axiale | ** | * |
| Optimisation de l’excitation et de l’émission des fluorophores pour les conditions d’imagerie cryogénique | ** | * |
| Suppression de l’autofluorescence (échantillon ou couche de carbone) | * | |
| Ciblage et exportation | 3D | 2D |