関連記事
The Cryo-CLEM Journey
New Imaging Tools for Cryo-Light Microscopy
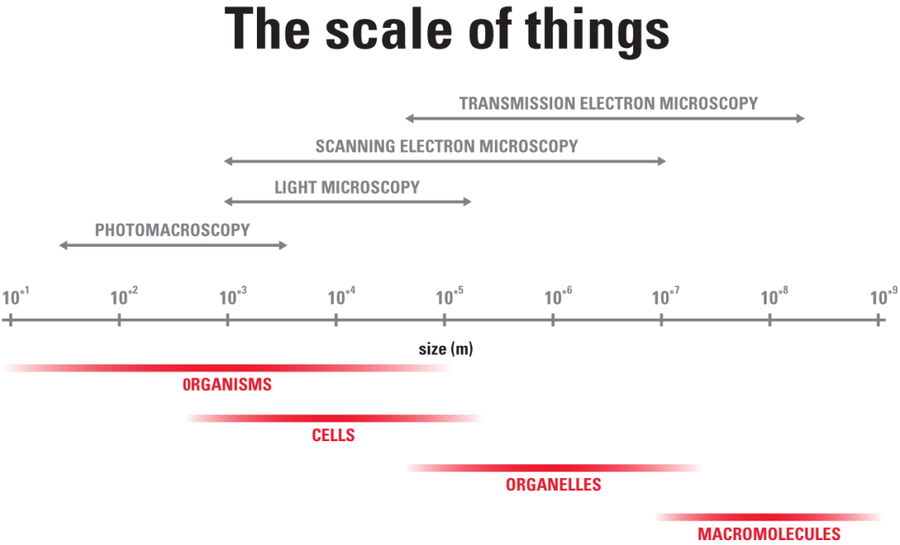
Improve Cryo Electron Tomography Workflow
CryoETワークフローの手順について教えてください。
この技法では電子顕微鏡グリッド上でサンプルを調整した後、液体窒素で急速冷凍してガラス状に凍結して結晶形成を防ぎます。
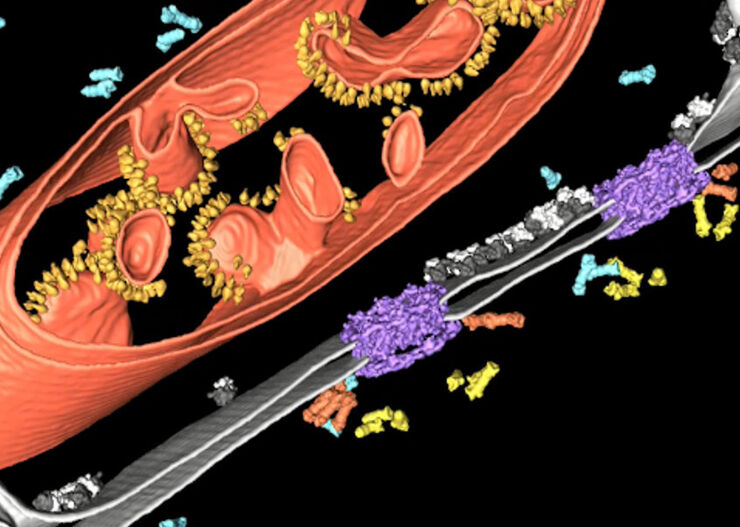
高分解能のクライオトモグラフィーを実施するためには、試料の切片の厚みが300 nmを超えないことが大切です。細胞体等の試料の「より厚い」部分を観察する際は、サンプルを薄くしなければなりません。この際は、クライオウルトラマイクロトミーやマルチモードのクライオスキャニング電子顕微鏡専用の集束イオンビーム (FIB) ミリングを用いることができます。2つのイオンビームウィンドウは、厚さ200 nmの薄氷片(ラメラ)が関心領域に生じ、Cryo ETがアクセスできるように設置されます。
こうして調製されたサンプルは、クライオ透過電子顕微鏡でスキャンすることができます。その後、データ再構成プロセスで2D画像を単体の3Dモデルへ再構成する必要があります。
CryoETに関する課題はクライオ光学顕微鏡でどのように解消できますか?
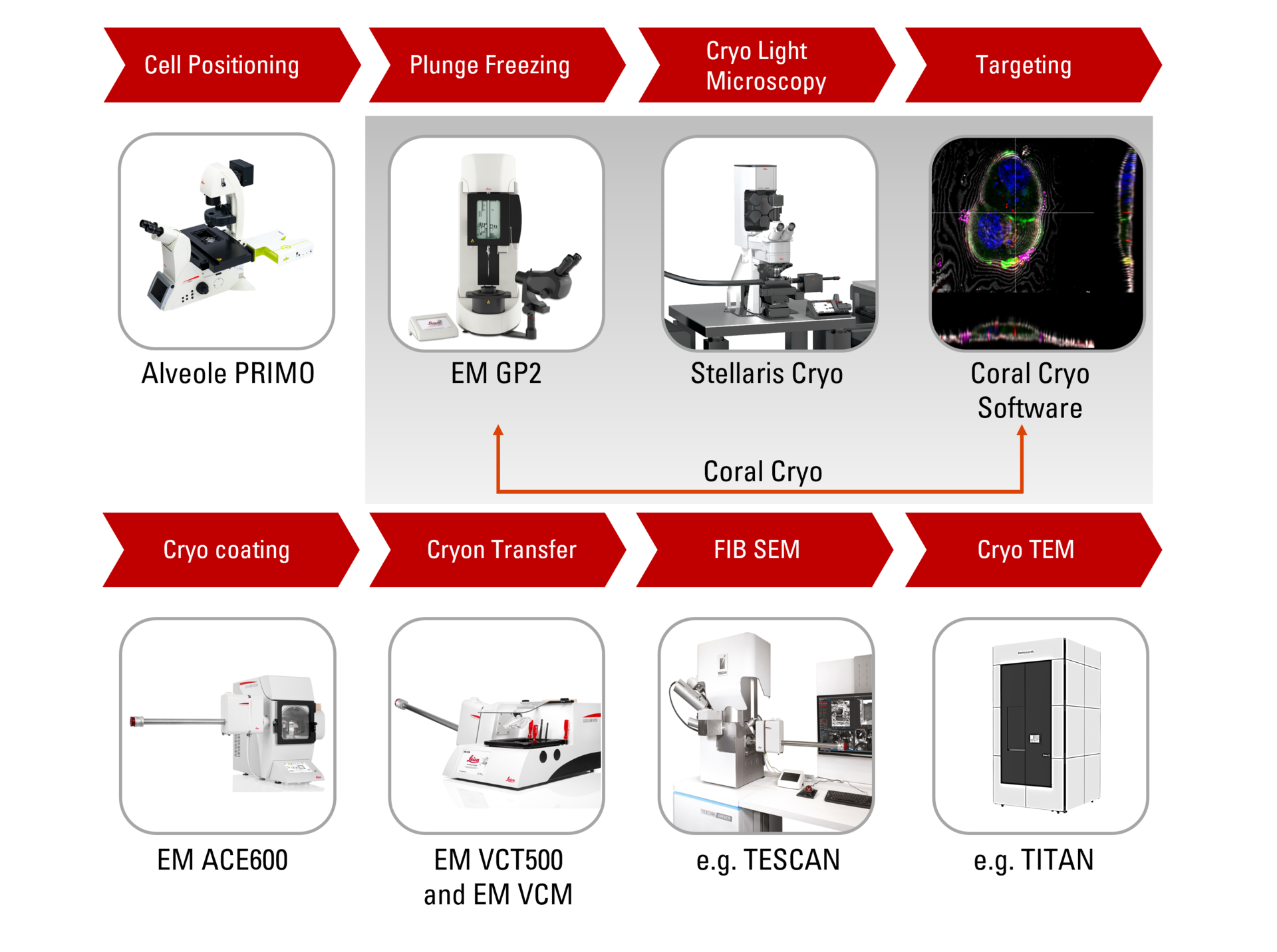
クライオ光学顕微鏡は、2つの点でCryoETワークフローに貢献することができます。
第一に、光学顕微鏡はサンプルの品質を評価する上で役立ちます。クライオ光学顕微鏡は、サンプルの凍結品質と氷片の厚みを迅速に表示し、その後のプロセスに最適な形でサンプルが配置されているかを素早く提示します。ライカのクライオソリューションは、こうしたステップでサンプルの安全性および生存性を確保します。
第二に、クライオ光学顕微鏡がワークフローの効率化につながる最大の要素として、時間も費用もかかるCryoEM調製を始める前に、関心構造をはるかに正確にターゲティングすることができるという点があります。ライカのクライオ光学顕微鏡ソリューションを活用すれば、対象構造の画像や座標を後のEMステップ用にエクスポートすることができるため、EMイメージングに要する時間を大幅に短縮することが可能です。
3Dボリュームターゲティングを実現
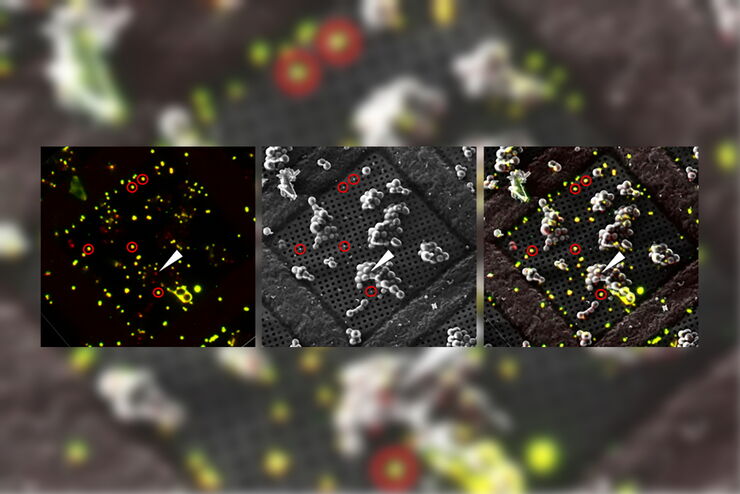
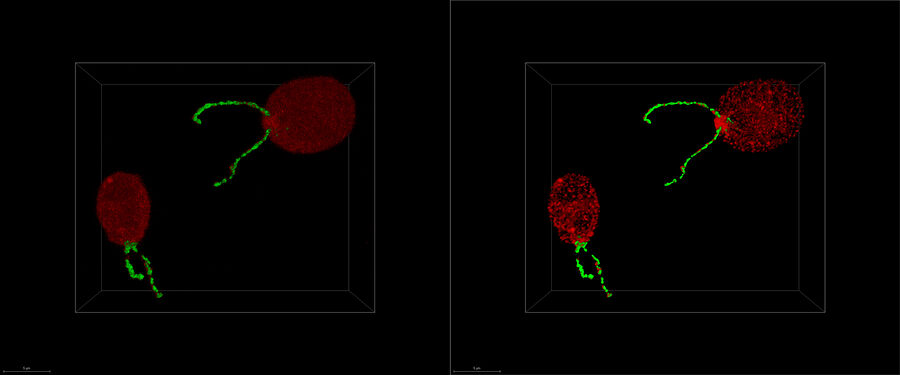
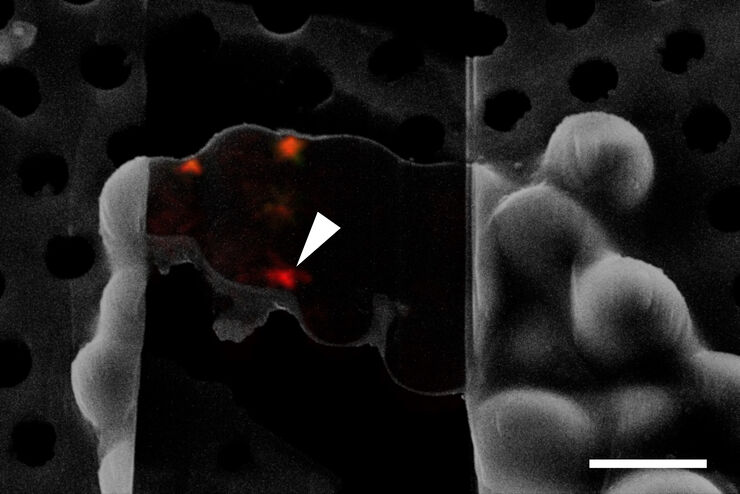
ライカ マイクロシステムズのシームレスなクライオ電子トモグラフィーワークフローCoral Cryoが、共焦点超分解能を活用して関心構造をより精密にターゲティングする仕組みを解説します。このワークフローを導入することで、ワークフローの手順が減少・最適化され、サンプルの装填・移送が改善されるため、CryoETワークフローの生産性が高まります。
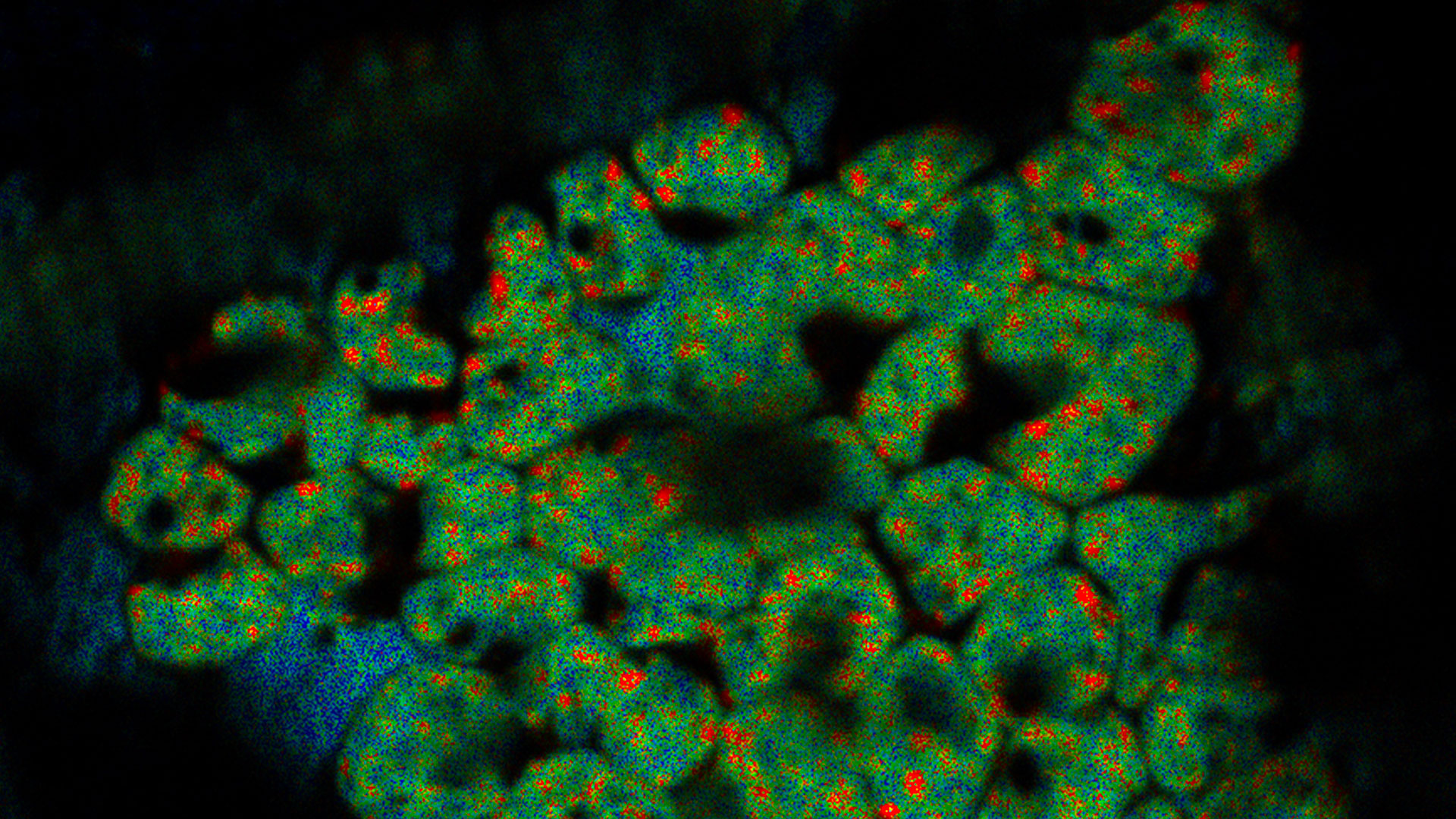
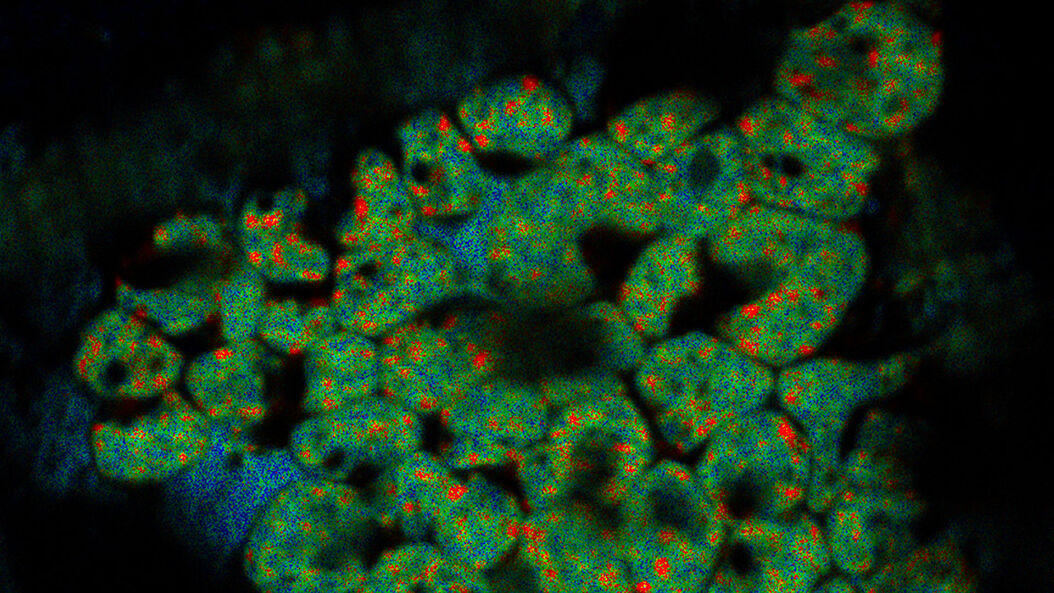
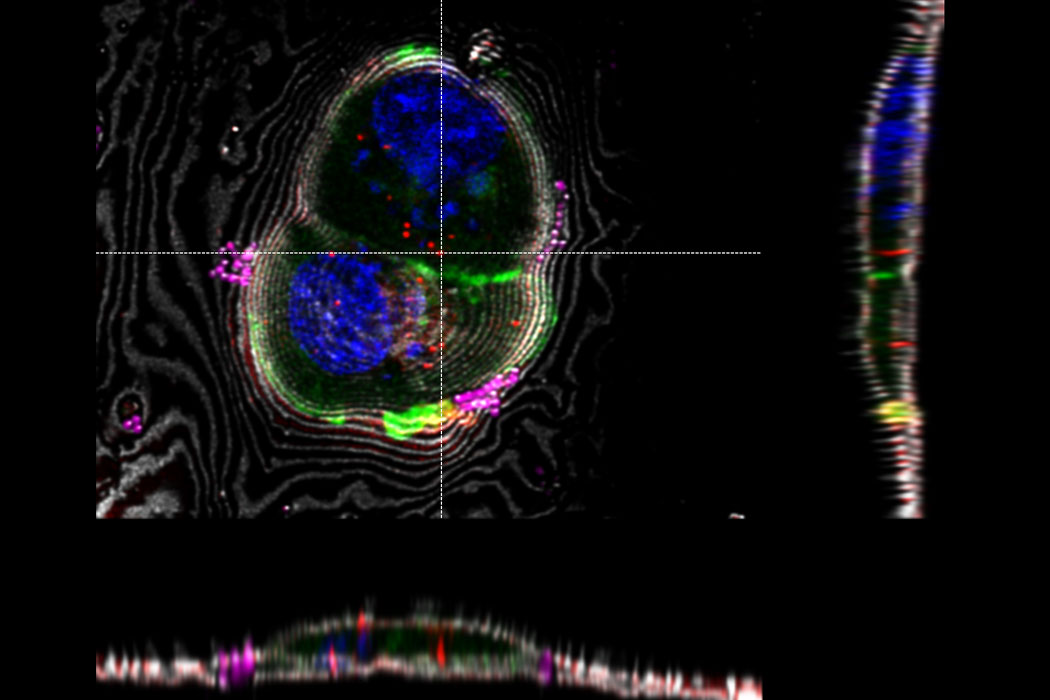
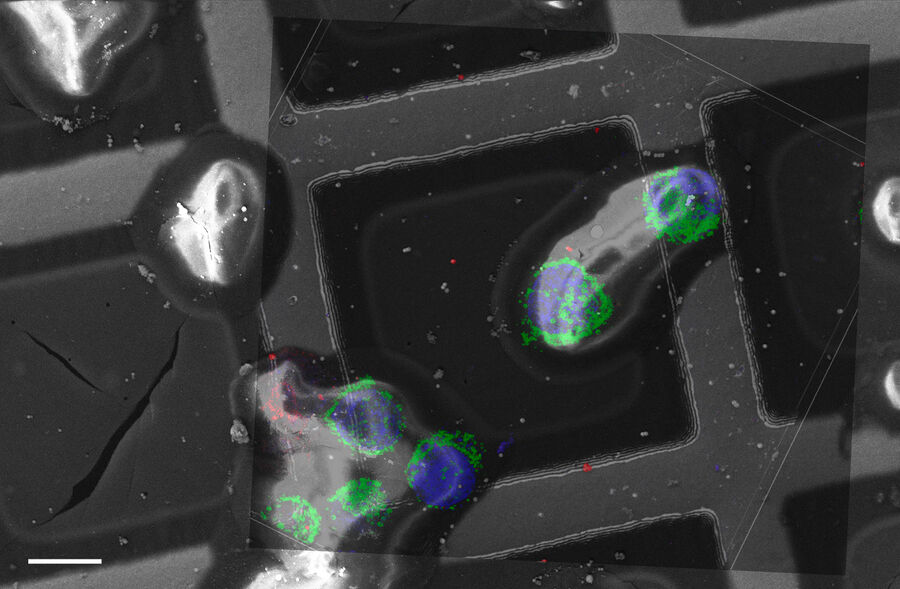
超高分解能3D共焦点画像 - 上部SEPビュー(左パネル)とFIBビュー(右パネル)のオーバーレイ。オーバーレイはビーズを相関ランドマークとして用いて実施されました。HeLa細胞の標識:細胞核はHoechst(青色)、ミトコンドリアはMitoTracker Green(緑色)、脂肪滴はBodipyとCrimson Beads(赤色)。スケールバー:20 μm。細胞提供:Ievgeniia Zagoriy、SEM/FIB画像提供:Herman Fung、Mahamid-Group、EMBL-Heidelberg(ドイツ)。